|
Introducción: Resulta interesante ver cómo el idioma
muchas veces nos ayuda a la hora de tomar decisiones, en
este caso en salud. Los Medicamentos de Alto Costo (MAC)
son antes que nada, medicamentos y más allá de su costo
(alto o no), es su eficacia y seguridad el paso
limitante que debiera guiar la autorización para su
comercialización y eventual cobertura.
Y decía que el idioma nos ayuda porque es justamente la
utilidad del medicamento el paso inicial para regular el
acceso de la población a los mismos. Solamente después
de haber aprobado ese escalón, adquiere relevancia su
costo. O acaso valdría la pena autorizar medicamentos
que no han pasado la prueba de la eficacia y la
seguridad por el mero hecho de ser baratos.
Dicho esto y dando por obvio que los recursos en salud
son finitos, la regulación en el acceso a este grupo
puntual de medicamentos permitirá que todos aquellos que
verdaderamente lo requieran puedan acceder a los mismos
y al mismo tiempo, evitar que aquellos que no sean
candidatos a recibirlos lo hagan.
EL APORTE DE LA
RESOLUCIÓN 1561/2012
A finales de 2012, la Superintendencia de Servicios de
Salud generó la mencionada resolución la cual contiene
una serie de enfermedades y procedimientos pasibles de
ser reintegrados a los financiadores. Allí pueden
identificarse 2 grupos de patologías, aquéllas en las
cuales el reintegro surge del cumplimiento de
determinadas condiciones médicas y administrativas y
otro, incluido en el denominado “Sistema de Tutelaje de
Tecnologías Sanitarias” que identifica 31 enfermedades
sobre las cuales existe algún tipo de advertencia acerca
de su seguridad. En este grupo puntual, la
Superintendencia determinó que se requiere una estricta
normatización de las tecnologías involucradas así como
de un posterior seguimiento de los pacientes para poder
determinar, en un 2° tiempo, la correspondencia o no de
reintegrarlas.
PROYECTO DE LA
FUNDACIÓN SANATORIO GÜEMES
Desde la Fundación nos hemos propuesto comenzar a
generar guías de recomendaciones para el uso de algunas
de las tecnologías tuteladas. Operativamente, el proceso
consta de 3 etapas:
1. Inicialmente un grupo compuesto por referentes de la
enfermedad que se está normalizando, médicos con
experiencia en farmacología clínica, expertos en
aspectos metodológicos para el armado de este tipo de
recomendaciones y economistas de la salud toman el
problema y trabajan en el armado de la guía contemplando
aspectos metodológicos, búsqueda de información,
estudios de costo-efectividad.
2. Posteriormente se difunde la guía a través de la
página web de la Fundación, invitando a todos los
interesados a un debate virtual sobre el tema.
3. Finalmente, se genera una reunión presencial en la
que se discuten los puntos que conforman la guía,
finalizando con una versión consensuada.
La propuesta es poder generar recomendaciones en 8
enfermedades durante 2013, teniendo en cuenta que al ser
los medicamentos/dispositivos los que requieren
tutelaje, son muchas más las guías a desarrollar. Por
ejemplo Síndrome Mielodisplásico cuenta con 4 drogas
tuteladas: Azacitidina, Decitabina, Imatinib y
Lenalidomida.
Hasta el momento hemos concluido la versión consensuada
de la primera guía (Omalizumab en Asma alérgico severo)
y estamos en el proceso de elaboración de las versiones
iniciales de otras 2 patologías (Cetuximab y Bevacizumab
en cáncer de colon, Válvula aórtica percutánea en
Estenosis Aórtica severa).
ESTRUCTURA DE
LAS GUÍAS DE RECOMENDACIONES
Si bien cada medicamento/dispositivo tiene puntos
específicos, confeccionamos un listado de temas a
abordar al confeccionar las guías.
Estos pasos, que detallo a continuación, permiten no
sólo identificar qué pacientes son candidatos a recibir
la tecnología sino también quiénes están en condiciones
de prescribirlo o qué medidas de seguimiento se proponen
en cada caso.
El “esqueleto” que usamos consta de las siguientes
pautas:
-
Criterios de elegibilidad.
-
Criterios de exclusión.
-
Requerimientos que se deben presentar desde el punto de
vista médico para avalar la indicación.
-
Profesionales habilitados para prescribir.
-
Prestadores en condiciones de llevar adelante el
tratamiento.
-
Plazos
de utilización.
-
Seguimiento del paciente.
A
continuación, presento las recomendaciones para el uso
de Omalizumab en Asma Severo que hemos desarrollado
junto a la Dra. Silvia Quadrelli, el Dr. Ventura
Simonovich y un grupo de personas que mostraron interés
en el tema y participaron del encuentro presencial.
1. Criterios de Elegibilidad
a. Asma alérgica severa (mediada por IgE) en paciente
con enfermedad inestable (Debe cumplir los primeros 3
criterios y al menos 1 del criterio iv).
i. VEF1 < 80% o Variabilidad > 20%
ii. Confirmación de alergia mediada por IgE (HC + test cutáneos) IgE > 30
UI/mL.
iii. Que se encuentre en tratamiento con corticoides inhalados en altas
dosis (Fluticasona: Mayor
a 500 mcg/día o dosis equivalentes) + B2 acción
prolongada, Antagonistas de receptores de
Leucotrienos, Teofilina y Corticoides orales, y
con documentada adherencia al tratamiento.
iv. Enfermedad inestable o síntomas persistentes no controlados (alguno
de los siguientes):
1. 2 o más crisis severas que requirieron
internación en el último año.
2. 3 o más crisis severas en último año
(admisiones a guardia y/o requerimiento de corticoides
sistémicos por al menos 5 días).
3. Síntomas diarios que limitan la actividad +
síntomas nocturnos al menos una vez a la
semana (estadios III o IV de GINA).
2. Criterios de Exclusión
a. Menores de 6 años.
b. Peso mayor a 200 kg.
c. IgE mayor a 1500 UI/mL.
3. Requisitos que se deben presentar para aplicar al
reintegro
a. EFR que confirme VEF1 menor a 80%.
b. Dosaje de IgE (últimos 12 meses).
c. Prick test positivo.
d. Consentimiento informado firmado por el paciente y el
médico tratante.
e. Constancia del médico tratante explicitando la
presencia de las siguientes condiciones.
i. Crisis severas (VEF1 menor al 60% del mejor valor personal
y que haya requerido corticoides
sistémicos).
ii. Internaciones por Asma en el último año.
iii. Atenciones en Guardia por Asma en último año.
4. Profesionales habilitados para prescribir
a. Médico especialista en Neumonología y Alergia
5. Prestadores habilitados
a. Centro especializado que cumpla todos estos
requisitos:
i. Internación de agudos y/o que cuente con convenio con
Sistema de Emergencias.
ii. Al menos 2 neumonólogos en su plantel.
iii. Al menos 100 consultas/mes en Neumonología.
6. Análisis del medicamento/tecnología
a. Xolair, Novartis.
b. 150 mg Fco Amp.
c. Anticuerpo monoclonal recombinante.
d. Inhibe unión de IgE a receptores de superficie en
mastocitos y basófilos.
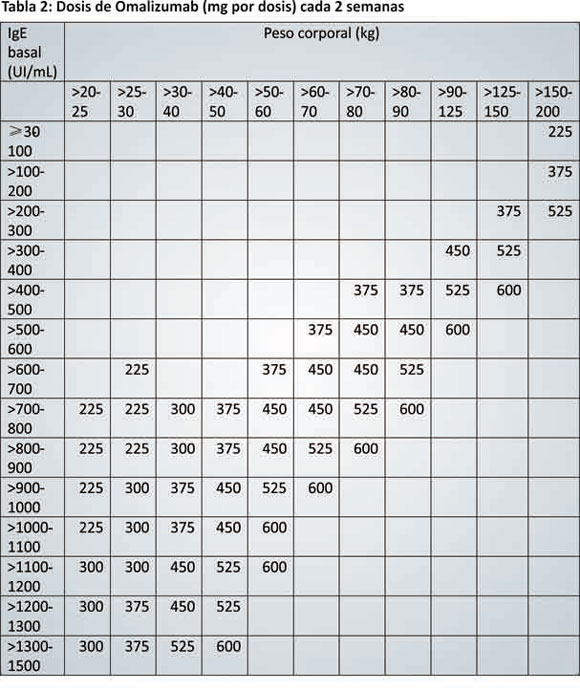
e. Vía Subcutánea únicamente, cada 2-4 semanas.
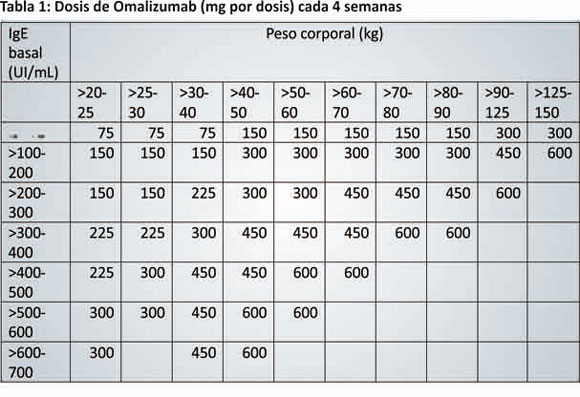
f. Dosis: Se determina de acuerdo al valor de IgE previo
al inicio del tratamiento y el peso del paciente. En
función de ello, se define si debe administrarse cada 2
o 4 semanas.
g. No aplicar más de 150 mg en un mismo sitio. (ej: Si
requiere 375 mg, se requieren 3 inyecciones).
h. Costo: Precio Kairos (abr-13): $5.794.
i. Dosis mínima: 75 mg cada 4 semanas (1 vial por mes):
$5.794 x mes.
ii. Dosis máxima: 600 mg cada 2 semanas (8 viales por mes):
$46.352 x mes.
7. ¿Hasta cuándo?
a. Si no hay buena respuesta (x Score ACT): Suspender
después de 16 semanas.
b. Si hay buena respuesta: hasta 5 años
c. Teniendo en cuenta que la IgE es un marcador que
puede estar elevado hasta un año luego del inicio del
tratamiento, el nivel de IgE durante el tratamiento no
debe ser utilizado como valor para adecuar la dosis.
8. Seguimiento del paciente
a. Score ACT (Asthma Control Test, en inglés) en semanas
8 y 16 de iniciado el tratamiento con Omalizumab.
i. En caso de 20 puntos o más en semana 16, continuar
tratamiento.
ii. En caso de menos de 20 puntos en semana 16, suspender
Omalizumab.
b. EFR-Peak Flow (cada 4 semanas, hasta semana 16).
|