|
Durante más de 20 años la industria farmacéutica sin
importar el origen del capital consolidó su poder
oligopólico mediante un proceso de integración vertical
“aguas arriba” que se inició cuando capturó el contrato
del PAMI allá por el año 1997. La creación de la empresa
Farmalink para “administrar” el contrato consolidó un
esquema de control y sometimiento de los agentes del
sistema: laboratorios, droguerías, farmacéuticos, y
médicos, mediante el uso de la información privilegiada
sobre prescripción, consumo y utilización de
medicamentos (laboratorios), modalidades de pago (notas
de crédito a las farmacias), control societario
(droguerías), incentivos a la prescripción (médicos) y
financiamiento para el gobierno, la política y la
seguridad social que permitió mantener el “mecanismo”
cerrado a la competencia de genéricos, al uso de las
compras conjuntas y al control del consumo y uso
racional del medicamento.
En varios trabajos realizados durante los últimos 20
años se analizó la naturaleza del funcionamiento del
mercado farmacéutico en la Argentina y se expuso la
trampa a la cual se había entrado durante los años
noventa con la convertibilidad en vigencia y donde la
seguridad social se había visto seriamente afectada por
la disminución de las contribuciones patronales que
impactaban sobre los ingresos de las obras sociales y
del PAMI. El gobierno de Menem y la Alianza le dieron
continuidad mientras duró la convertibilidad.
La abrupta salida de la convertibilidad en el año 2002
generó una pasajera incertidumbre por el discurso de la
época sobre el genérico que sin embargo se quedó en las
puertas del PAMI y nunca amenazó la continuidad del
contrato que el gobierno de turno termino arreglando. A
partir del año 2003, el cartel farmacéutico disfrutó de
12 años de estabilidad y crecimiento del mercado de
medicamentos en la Argentina.
En 2016 el gobierno ya había iniciado algunos
cuestionamientos serios al control que la industria
mantenía sobre la financiación del medicamento. Este
proceso comenzó reclamando al cartel moderación en
cuanto a precios y mayores controles. Pero resulta
imposible que el mismo agente que produce sea el que
tenga que controlar las prescripciones y los consumos de
medicamentos, simplemente no está en la naturaleza de
cualquier industria y menos en ésta, que el productor
promueva el uso racional del medicamento.
Los tiempos fueron tensando la cuerda y convenciendo al
gobierno que en este tema no había otra salida que no
fuera la ruptura del contrato para barajar y dar de
nuevo. Esta decisión política fue tomada por el Director
Ejecutivo de PAMI y estamos viviendo la previa a este
nuevo modelo de gestión de medicamentos que el Instituto
tomará de manera directa con los desafíos que significan
en materia de articular y poner en caja a los distintos
intereses en juego. Muchos de ellos afectados por este
cambio de paradigma que permitirá con el tiempo comenzar
a normalizar el funcionamiento de un mercado donde los
laboratorios se vuelvan a encargar de producir, competir
y exportar y se aparten de las negociaciones sobre la
administración y financiación del medicamento. Salvo la
Argentina no existe ningún país del mundo donde las
Cámaras representativas de la industria se sienten con
los seguros y financiadores para arreglar condiciones de
acceso, consumo y utilización.
Se abre un camino nuevo que permite en primer lugar
definir una sólida política de uso racional del
medicamento que evite los excesos por autoconsumo y
utilización excesiva dañina para la salud de los
beneficiarios y por otro lado construir una política de
financiamiento donde se compita por precio y donde la
calidad esté fuera de dudas que resulta relevante tanto
para la confianza en el uso del mercado interno como
para la exportación que exige el requisito de la
bioequivalencia para ingresar medicamentos en otros
países del mundo.
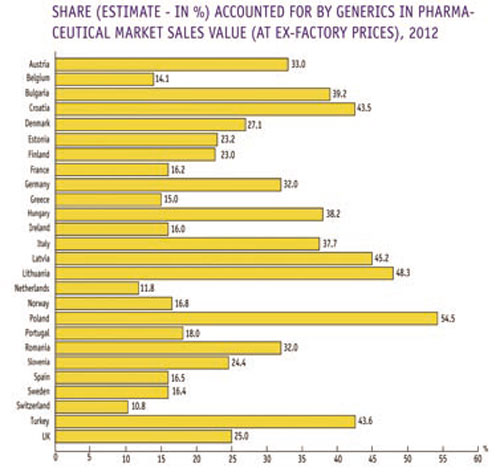
Figura: EFPIA European Federation of Pharmaceutica
Industries and Associations. The Pharmaceutical Industry
in figures. 2014
Las líderes globales en la industria farmacéutica poseen
grados variables de poder de mercado según el estadio
del ciclo de vida de cada producto. En la tabla
siguiente se muestra la cuota de mercado de productos
genéricos en valor en el año 2012, observándose grandes
variaciones entre los países, que oscilan entre el 10,8%
de Suiza y el 54,5% de Polonia, con países como Alemania
e Italia que están superando el 30% de su mercado con
genéricos.
A nivel mundial, el crecimiento del mercado del genérico
se ha situado en torno al 11% (desde 2012 hasta 2016),
alcanzando un valor de 279.000 millones de euros. La
tendencia es mantenerse a ese nivel hasta 2021. A nivel
internacional, la zona de mayor peso es Asia-Pacífico
(46%), seguida de Estados Unidos (31%) y Europa (15,6%).
En este contexto, el mercado más maduro es el
norteamericano que sigue ofreciendo oportunidades de
crecimiento para el genérico, muy atractivo en un
contexto sanitario (Medicare) donde preocupa que
aumenten los costes de la atención sanitaria.(1)
Si bien el consumo mundial de genéricos se ha
ralentizado durante los últimos años debido a que menos
moléculas pierden patente, un esquema de penetración en
el mercado muy lento, una baja prescripción por
principio activo (PPA) y un cambio en los perfiles de
prescripción (2) según la radiografía que presenta ya
estamos hablando de cuotas de mercado mundial promedio
del 30% en tanto que en la Argentina no se supera el 4%
de genéricos puros.
En el caso argentino podemos mencionar sin temor a
equivocarnos que el ingreso del genérico (3) al mercado
local depende hoy en día más de las barreras impuestas
por los laboratorios nacionales que tienen organizado su
“negocio” entorno a los medicamentos (copias y/o
similares de marca) que del interés que podrían tener
algunas empresas que han hecho del genérico su negocio
en el mundo.
La construcción de confianza en la calidad del genérico
resulta clave. La Argentina tiene un retraso importante
en materia de estudios de bioequivalencia respecto a
países de la región que abordaron programas similares
durante los últimos años. Se destacan Brasil y Chile. En
el caso de este último del total de registros vigentes
de medicamentos (9.300) los bioequivalentes corresponden
al 12% del mercado.(4)
De una entrevista mantenida con el director de ANMAT Dr.
Carlos Chiale el mismo planteó que para los medicamentos
considerados de “mediano y bajo riesgo” no se requieren
estudios de bioequivalencia y que los mismos se
implementan para el universo de alto riesgo, formas
farmacéuticas y principios activos críticos.(5)
La participación de los genéricos sin marca es aún en
extremo reducida, indicativo de la necesidad de
políticas proactivas de sustitución por genéricos, tales
como reglas de obligatoriedad de prescripción por nombre
genérico, mecanismos de fármaco vigilancia que aseguren
la eficacia y seguridad de los genéricos sin marca y
campañas de información a los profesionales y al
público.
Existe un camino por recorrer y resulta auspicioso que
el PAMI lidere este proceso y que el sistema de salud en
su conjunto comience a ahorrar en aquellas áreas que no
agregan valor (más no es mejor) y que el uso racional
constituya un criterio clave para definir la utilización
y el consumo de bienes y servicios en salud.
1- http://ratiopharm.es/en-la-botica/noticias/el-medicamento-generico-goza-de-buena-salud
2- Directora General de IQVIA en España Concha Almarza.
Diario Farma. Cuatro factores afectaron el mercado de
genéricos durante 2017.
3- Genérico puro: ingresa al mercado una vez que la
patente del innovador ha vencido, tiene estudios de
bioequivalencia acreditados en las agencias
correspondientes y no tiene marca. Se vende por el
nombre genérico (denominación común internacional) y
está producido por un laboratorio con plantas
autorizadas. Se lo distingue del genérico de marca que
es un medicamento que tiene estudios de bioequivalencia,
pero tiene una marca que lo identifica. En la Argentina
existe una gran cantidad y variedad de medicamentos que
son copias o similares, que no tienen estudios de
bioequivalencias y se utilizan bajo un nombre comercial
sobre el cual los laboratorios han invertido en el
posicionamiento de la misma.
4- Bioequivalentes crecen 10 veces en cuatro años y
representan 12% del mercado de fármacos. Autor: C. Yáñez
/ P. Sepúlveda. Diario La Tercera (Chile).
5- Se comenzarán a realizar estudios sobre 4 productos
de referencia y luego seguirán 6 más siempre de aquellos
considerados de alto riesgo (requieren estudio in vivo).
Ya están hechos los estudios sobre inmunosupresores,
anticonvulsionantes y HIV Sida
|